浙江大学化学系汤谷平和药学院顾臻联合课题组在Nano Today上报道天然贻贝蛋白抗肿瘤纳米药物输送系统
纳米药物输送系统是实现肿瘤精准治疗的重要策略之一。近年来,基于天然生物大分子的递药系统在规避体内清除、突破肿瘤屏障和实现智能控释等方面表现出独特优势。在此基础上,如何进一步增强药物在肿瘤部位的定向驻留和渗透,是改善治疗效果和降低毒副作用的关键。
贻贝足丝蛋白具有天然的生物粘附性和阳离子特性,精准调控其生物活性并构建为智能载体,有望为药物的肿瘤靶向驻留和渗透提供全新平台。为此,联合课题组研究人员研发了一种基于天然贻贝足丝蛋白的光疗-化疗复合型纳米药物输送系统。其特点在于,利用足丝蛋白的结构特性高效包载光敏剂和化疗前药,同时以药物分子为调控单元操控蛋白生物活性,在动物模型试验中表明,其能够携载药物突破体内生、病理屏障,在肿瘤部位实施靶向驻留和渗透。在此基础上,利用肿瘤环境响应性释放药物并激活前药,发挥光动力和乏氧驱动化疗的协同治疗功能。研究论文发表在Nano Today(IF=18.9)上,题为“Natural mussel protein-derived antitumor nanomedicine with tumor targeted bioadhesion and penetration”。
天然贻贝足丝蛋白(NMPs)的生物粘附功能主要依赖于多巴(DOPA)的化学活性。因此,研究人员设计了一种苯硼酸(PBA)修饰的乏氧响应型替拉扎明前药(PBT),利用PBA与DOPA的动态共价键实现NMPs粘附性的精准调控,其不但具有长效循环性能,而且还具有肿瘤环境响应性的生物粘附能力,故显著提升药物在肿瘤部位的驻留和累积。进一步利用NMPs的电荷特性和空间组装能力携载光敏剂吲哚菁绿(ICG),制备复合型纳米药物输送系统ICG-PBT@NMPs。经动物模型证明,ICG-PBT@NMPs利用独特的肿瘤靶向粘附和渗透增加药物浸润,通过发挥协同机制高效抑制肿瘤的发展和转移。利用药物分子精准调控天然蛋白构效关系,进而构建智能递药系统的设计策略也为抗肿瘤药物输送提供了新思路。
本文第一作者为化学系博士研究生何云红,浙江大学药学院顾臻教授和化学系白宏震专职研究员为共同通讯作者。本课题受国家自然科学基金项目的资助和浙江大学科技创新团队项目的资助。

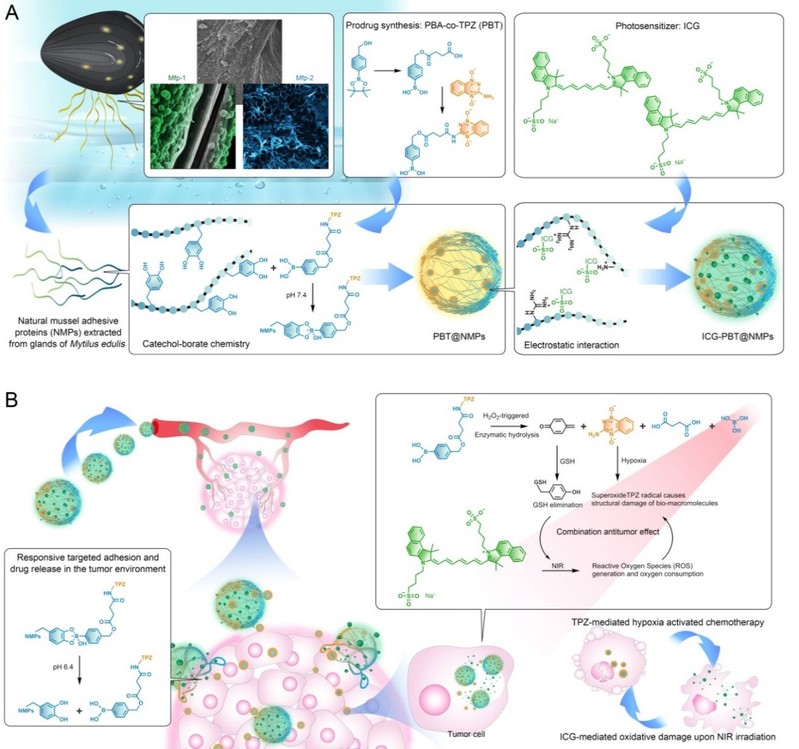
Figure 1. Design of ICG-PBT@NMPs nanomedicine and combination antitumor mechanism.
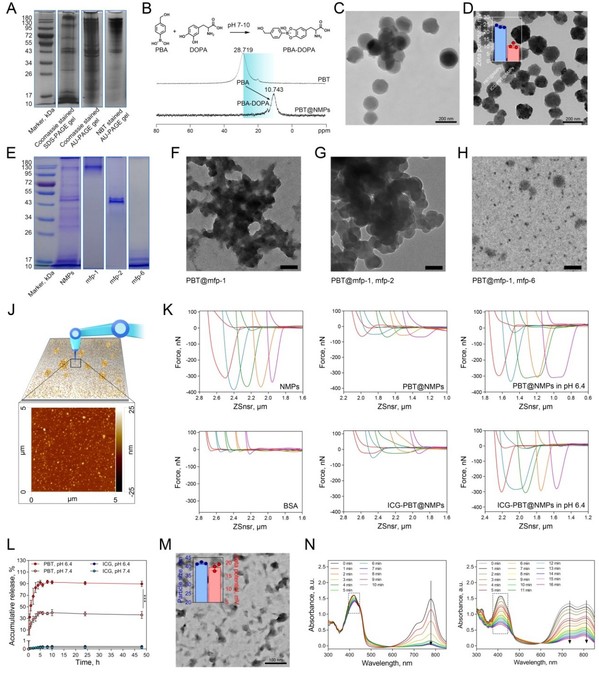
Figure 2. The chemical characterization of NMPs and ICG-PBT@NMPs nanoparticles.
原文链接:https://doi.org/10.1016/j.nantod.2022.101700

