史炳锋课题组:钴/手性磷酸二元催化碳氢键烯基化/不对称[4+1]环化反应
近年来,过渡金属催化的不对称碳氢键官能化日益成为合成手性分子的重要手段。尤其是地球储量更为丰富的钴催化的不对称碳氢活化,逐渐受到重视,并取得了一定的进展。到目前为止,钴(III) 催化的不对称碳氢活化主要基于两类催化体系:非手性 Cp*CoIII手性酸体系(Figure 1a, Strategy I) 和手性CpxCoIII体系(Figure 1b, Strategy II)。
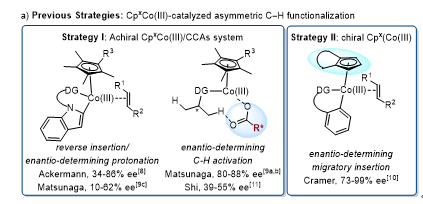
Figure 1. Cobalt-Catalyzed Enantioselective C−H Activation.
过渡金属与手性磷酸(CPA)的结合已成为一种非常有价值的催化系统,显示出独特的反应性和立体选择性控制,例如,Pd/CPA体系在不对称碳氢键活化领域已经取得了较为广泛的应用。然而,其他过渡金属,特别是地球丰产金属钴/手性磷酸催化体系迄今尚未报道。
近年来,浙江大学史炳锋团队在过渡金属催化的不对称碳氢键催化转化领域开展了系统的研究:
1)基于瞬态手性辅基策略 (Angew. Chem. Int. Ed.2017, 56, 6617; Angew. Chem. Int. Ed. 2018, 57, 3661;Angew. Chem. Int. Ed. 2018, 57, 17151;Angew. Chem. Int. Ed. 2019, 58, 11464; Angew. Chem. Int. Ed. 2020, 59, 6576; Angew. Chem. Int. Ed.2020, 59, 19773; CCS Chem.2021, 3, 455; ACS Catal.2019, 9, 1956; Org. Lett.2019, 21, 3352; Organometallics2019, 38, 4022)、钯(II)/手性螺环磷酸(J. Am. Chem. Soc.2021, 143, 12335; Angew. Chem. Int. Ed.2019, 58, 6708; Angew. Chem. Int. Ed. 2020, 59, 3568; Org. Lett.2020, 22, 9693) 和钯(II)/焦谷氨酸(Chem2020, 6, 497; J. Am. Chem. Soc. 2020, 142, 18266; Chem. Sci.2021, 12, 9391) 催化体系,实现了联芳、苯乙烯和酰基苯胺等类型阻转手性的高效构筑;
2)利用课题组发展的PIP试剂 (Chem. Sci.2013, 4, 4187; Angew. Chem. Int. Ed.2013, 52, 1358;J. Am. Chem. Soc.2015, 137, 8219; Chemistry Authors Up Close:Chin. J. Chem.2019, 37, 64),基于“位阻传递”策略,实现了钯催化惰性亚甲基碳氢键不对称官能团化 (Acc. Chem. Res.2021, 54, 2750; Angew. Chem. Int. Ed.2018, 57, 9093; J. Am. Chem. Soc.2019, 141, 4558; Chin. J. Chem.2020, 38, 242, Angew. Chem. Int. Ed. 2020, 59, 14060; Angew. Chem. Int. Ed. 2020, 59, 20455; Org. Lett. 2021, 23, 97; Org. Lett. 2021, 23, 2048; Org. Chem. Front. 2021, 8, 2903; Chem. Commun. 2021, 57, 5562);
3)基于位阻效应和氢键作用,发展新型手性酸催化剂,实现了d6过渡金属配合物催化的不对称碳氢键活化 [CpXCoIII: Org. Lett. 2019, 21, 1895; Chem. Sci.2020, 11, 290; CpXIrIII: ACS Catal. 2020, 10, 7117; (p-Cymene)Ru(II): J. Am. Chem. Soc.2021, 143, 6810]。
从手性产生的来源考虑,以上工作不外乎两种模式:立体选择性碳氢键活化产生手性碳-金属中间体或者非手性的碳-金属中间体立体选择性加成。发展有别于以上两种模式的新催化体系,有望为手性物质的精准创制提供新的机遇。基于这一理念,该团队设计并发展了一种非手性钴与手性磷酸结合的二元催化体系。作者提出在该策略中钴首先催化非手性碳氢烯基化形成中间体Int1,之后在钴/手性磷酸的共催化下实现对中间体Int2不对称[4+1]环化合成γ-螺环内酰胺(Figure 2)。该反应使用廉价易得的四水合醋酸钴作为催化剂,大位阻手性螺环磷酸作为配体,实现了碳氢键烯基化和不对称[4+1]环化反应的兼容,获得优秀的立体选择性(高达98% ee)。
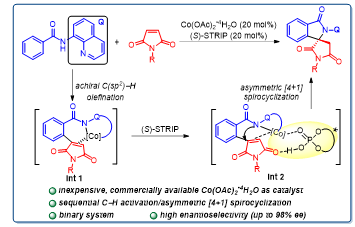
Figure 2. Our strategy: Co(II)/Spiro Phosphoric Acid (SPA) Binary System
在最优条件下,作者对酰胺底物以及马来酰亚胺底物适用范围进行了考察。反应对带有供吸电子基团酰胺底物都得到比较好的效果,马来酰亚胺底物的N-取代基位阻对反应ee值有较大影响 (Figure 3)。作者同时也对产物进行衍生化反应研究合成了醛糖还原酶抑制剂6 (Figure 4)。
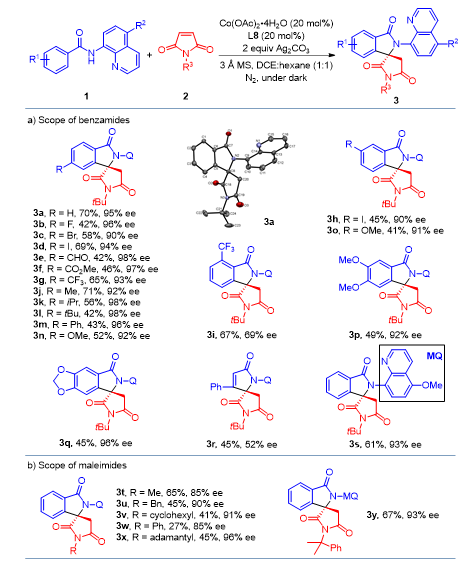
Figure 3. Synthesis of spiro--lactam.
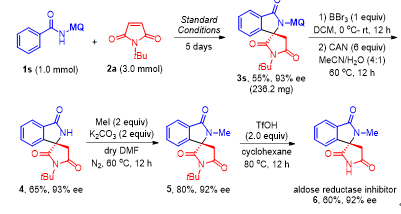
Figure 4. Asymmetric synthesis of aldose reductase inhibitor 6.
随后,作者对反应机理进行了合理的推断(Figure 5)。作者推测在中间体F中,(S)-TRIP(L8)的P=O与Co(III)配位,同时与马来酰亚胺的羰基形成分子内氢键,(S)-TRIP(L8)与烯基化产物之间的金属配位和分子内氢键双重作用为不对称[4+1]环化过程创造了合适的手性环境。中间体F经分子内反式胺钴化/不对称质子化生成手性γ-螺环内酰胺(S)-3a。此外,中间体F也可能直接经立体选择的aza-Michael加成生成产物(S)-3a。
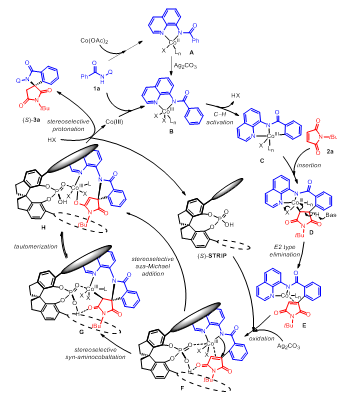
Figure 5. Plausible catalytic cycle.
在该工作中,史炳锋团队发展了钴/手性磷酸二元催化体系,实现了碳氢键烯基化和手性[4+1]环化串联反应。这是首例钴/手性磷酸不对称碳氢键活化的报道,为不对称碳氢键活化提供了新的催化模式。该方法也为构建具有手性γ-螺环内酰胺提供了一种简便的方法。
论文信息:
Synthesis of Chiral Spirolactams via Sequential C−H Olefination/Asymmetric [4+1] Spirocyclization under a Simple Co(II)/Chiral Spiro Phosphoric Acid Binary System
Wen-Kui Yuan,Bing-Feng Shi
Angewandte Chemie International Edition
DOI: 10.1002/anie.202108853

