史炳锋教授课题组CCS Chem:基于双配体调控的钴催化不对称碳氢键酰氧化构建氧代二茂铁面手性化合物
面手性二茂铁是一类重要的平面手性骨架,在不对称催化、手性材料和生物医学等领域应用广泛。因此,面手性二茂铁化合物的高效不对称合成一直是合成化学领域重要的研究方向之一。其中,氧代面手性二茂铁骨架在不对称催化和药物开发等方面的应用开始受到广泛关注(图1a)。然而,其不对称合成的方法较为匮乏且步骤繁琐,往往需要引入当量的手性辅基和使用强碱性的金属锂试剂,因此,亟需发展温和条件下的催化不对称合成新方法(图1b)。
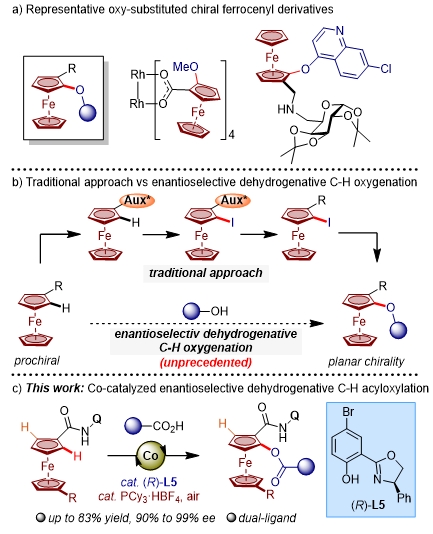
图 1 研究背景与本文工作。图片来源:CCS Chem.
近年来,过渡金属催化的不对称碳氢键活化反应为手性分子的高效构建提供了变革性的合成策略。2013年,游书力课题组(J. Am. Chem. Soc.2013, 135, 86)和吴养洁课题组(Chem. Sci. 2013, 4, 2675)开创性的发展了钯催化不对称碳氢键活化构建二茂铁面手性化合物。受此工作的启发,过渡金属催化的不对称碳氢键活化构建面手性二茂铁受到广泛关注。然而,已报道的合成方法主要依赖价格昂贵的4d, 5d过渡金属(如:Pd、Ir、Rh、Pt和Au)或者地壳储量稀少的稀土金属,而基于廉价、低毒性的地球丰产3d金属的不对称碳氢键活化合成策略较为匮乏。
浙江大学化学系史炳锋教授团队长期致力于发展绿色高效的廉价金属催化的不对称碳氢键活化新方法,自2019年以来,团队围绕廉价金属钴催化的不对称碳氢键活化,进行了系统而深入的探索。团队发展了大位阻手性酸配体(Chem. Sci.2020, 11, 290; J. Am. Chem. Soc.2021, 143, 19112)和含有氢键受体酰胺基团的联萘/螺环手性酸(J. Am. Chem. Soc.2021, 143, 6810; ACS Catal. 2022, 12, 9806),实现了非手性环戊二烯基钴[CpCo(III)]催化的不对称碳氢键活化。最近,史炳锋教授团队基于对金属钴配位模式的理解,提出了无Cp(cyclopentadienyl,环戊二烯基)配位的正八面体钴催化不对称碳氢键活化新策略,发展了两类新型手性催化体系,实现了廉价金属钴催化的不对称碳氢键活化。2021年,他们率先发展了Co(II)/螺环手性磷酸(SPA)接力催化体系,实现了螺中心手性的构建(Angew. Chem. Int. Ed.2021, 60, 23187)。随后,他们又发展了新型Co(II)/Salox(salicyloxazoline,水杨基噁唑啉)催化体系,以廉价易得的二价钴盐作为催化剂和合成简便且便于改造的Salox手性配体,在体系中原位氧化生成正八面体手性Co(III)催化剂,高效地实现了不对称碳氢键活化/环化反应构建膦中心手性,并成功地分离和表征了相应的正八面体型Co(III)关键反应中间体(Angew. Chem. Int. Ed.2022, 61, e202202892)。随后他们将该催化模式成功应用于双轴手性化合物的构建(Angew. Chem. Int. Ed.2022, 61, e202208912)、膦酰胺不对称碳氢键脱氢烷氧基化和胺化(Angew. Chem. Int. Ed.2022, 61, e202210106; Angew. Chem. Int. Ed.2023, 62, e202302964)及首例对映和区域选择性电氧化钴催化C-H/N-H环化反应(Angew. Chem. Int. Ed.2023, 62, e202218533)、手性二芳基甲胺的构建(Angew. Chem. Int. Ed.2023, 62, e202304706)、联芳轴手性骨架的构建(Angew. Chem. Int. Ed.2023, 62, e202310004)、C1-手性四氢异喹啉(c-THIQs)生物活性分子的不对称合成(J. Am. Chem. Soc. 2023, 145, 24499)和不对称碳氢键活化/[4+1]插羰环化构建手性异吲哚啉酮骨架(Angew. Chem. Int. Ed.2024, 63, e202318803)。受以上工作启发,该团队成功地实现了基于双配体调控的不对称碳氢键酰氧化构建氧代二茂铁面手性化合物。反应以商业可得的钴盐为催化剂,Salox与非手性膦配体为双配体,以芳基酸与烷基酸钠为酰源,能够以中等至优秀的产率与优秀的对映体选择性得到手性产物(图1c)。
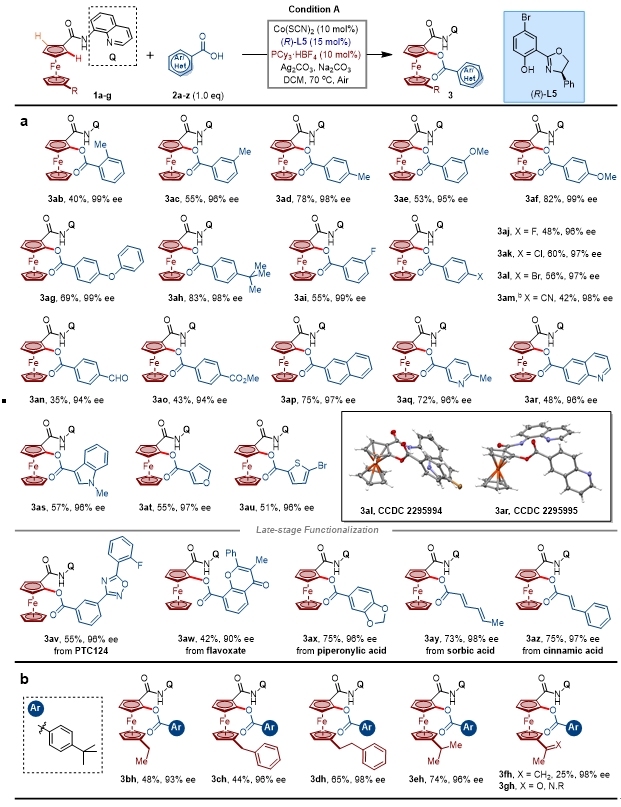
图 2 芳基酸底物拓展。图片来源:CCS Chem.
当使用芳基酸为酰源时,反应表现出良好的兼容性。在芳基酸2-,3-,4-位带有给电基团的底物反应效果良好。引入吸电基团回事反应产率略低,但仍具有良好的立体化学控制。值得注意的是,该体系能兼容杂芳酸,并且不会对反应的反应性与对映体选择性有显著降低(3aq-3au)。此外,该体系能兼容药物分子与食品添加剂(3av-3az)。同时,通过X射线衍射分析确定了3al和3ar的绝对构型,其他产物的立体构型可类比得知。在另一个环戊二烯基(Cp)环上引入烷基,仍保持良好的反应性与对映体选择性(3bh-3eh),但当引入烯烃时会降低反应产率,引入乙酰基反应没有预期产物。(图2)
当使用醋酸钠作为酰源时,作者通过筛选发现使用L6作为配体时,能够以68%产率,97%ee得到手性产物3aaa。同时作者测试了该体系对烷基酸钠的兼容性,发现反应能够兼容各种烷基酸钠,并且以中等的产率与优异的对映选择性得到手性产物(3abb-3aee)(图3)。

图 3烷基酸底物表格。图片来源:CCS Chem.
为研究反应机理,作者进行了控制实验。首先作者讨论反应中加入的PCy3HBF4的作用,经对照实验作者认为PCy3HBF4经由反应被氧化为O=PCy3,并作为一个中性配体,在碳氢键活化过程促进配体L5、底物1a与钴配位形成中间体Int-2(图4a)。同时作者通过氘标记实验,验证了碳氢键活化过程是可逆的,为手性决定步,并且发现苯甲酸通过协同金属化去质子化对碳氢活化至关重要(图4b)。KIE实验说明碳氢键活化过程不是反应决速步(图4c)。结合机理探究控制实验以及前人的工作报道,作者提出了如下可能的催化循环模式(图4d)。
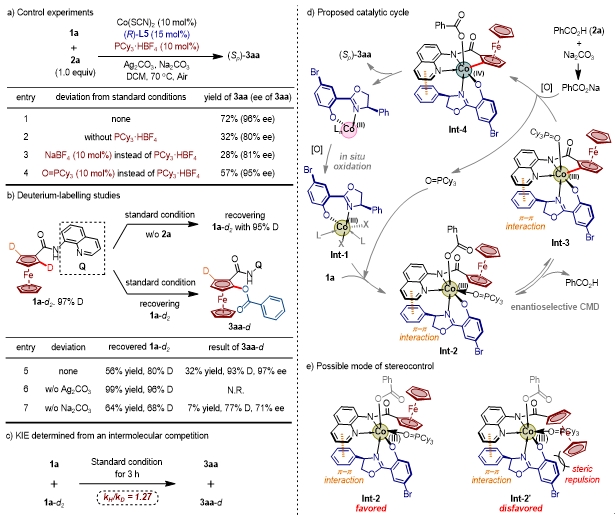
图 4 机理实验。图片来源:CCS Chem.
最后,作者对该反应进行了规模放大实验,并对所得手性产物进行衍生化(图5)。模版反应可顺利放大至6 mmol,克级规模制备产物3ah,且产率与ee值均未降低。3ah可在转化为醚4后脱去导向基得到酯5,并且保持高对映体选择性。3ah产物也可以用于制备Fe/Ir双金属络合物7。3ah的酰氧基也可以转化为三氟甲磺酸(OTf)得到8,或者通过SNAr反应得到9。
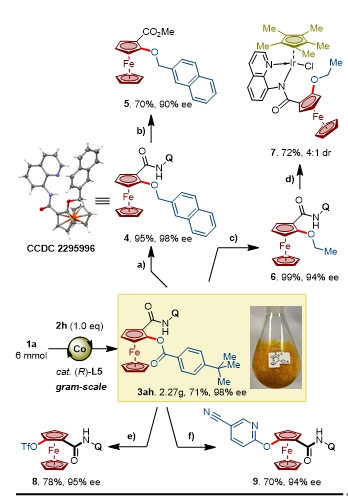
图 5 克级规模放大与产物衍生化。图片来源:CCS Chem.
综上所述,浙江大学化学系史炳锋教授团队基于Co(II)/Salox催化体系,成功实现了基于双配体调控的不对称碳氢键酰氧化构建氧代二茂铁面手性化合物,通过机理实验,初步提出了反应可能得机理,同时,对产物的合成应用转化也验证了该方法的实用性。
该论文的通讯作者是浙江大学史炳锋教授和百人研究员姚启钧,浙江大学化学系博士黄凡芮为第一作者。
Construction of Planar Chiral Ferrocenes by Cobalt-Catalyzed Enantioselective C-H Acyloxylation Enabled by Dual Ligand”
Huang, F.-R.; Yao, Q.-J.;* Zhang, P.; Teng, M.-Y.; Chen, J.-H.; Jiang, L.-C.; Shi, B.-F.*
CCS Chem. 2024, doi.org/10.31635/ccschem.024.202303709.
导师介绍https://person.zju.edu.cn/bfshi
文 字:史炳锋教授课题组
编 辑:黄珍珍、张维娅
审 核:林旭锋

