史炳锋课题组:新型羧酸配体促进的钌(II)催化不对称碳氢键活化合成手性亚砜亚胺
钌(II)催化剂具有价格低廉、对水和空气稳定等优点,在过渡金属催化的碳氢键活化中广受关注。近些年来,不对称碳氢键活化取得了很多重要的进展,但关于钌(II)催化的不对称碳氢键活化的报道却很少,特别是通过碳氢键活化产生手性中心的策略还没有被报道。
基于(p-Cymene)Ru(II)催化剂的结构特点,实现二价钌催化的不对称碳氢键活化有三种可能的策略(图1a)。第一种是利用手性芳烃预配位的手性钌催化剂(Strategy I),虽然类似的策略已经在手性环戊二烯 (CpX) 配位的CpXMIII(M = Co, Rh, Ir)催化的不对称碳氢键活化中,取得广泛的应用,但是相应的CpXRu(II)催化剂在碳氢键活化反应中活性低,而合成手性的烯烃/芳烃配体替代 (p-Cymene)Ru(II)催化剂中的对伞花烃(p-Cymene)配体则非常困难,迄今尚未有报道。第二种为瞬态手性导向策略(Strategy II),该策略借助手性有机小分子催化剂与反应底物通过可逆共价键结合,产生“瞬态手性辅基”,诱导手性的产生。2019年,Cui和Wang课题组利用手性胺作为配体分别实现了钌催化的分子内的不对称氢芳化反应(图1b),但是该策略目前仅适用于碳氢键活化以后的环钌中间体对双键的不对称插入产生手性中心。第三种可能的策略,是外加催化量的手性羧酸配体,通过手性羧酸根协助的协同金属化–去质子化(concerted metallation–deprotonation, CMD)过程,实现不对称碳氢键活化(Strategy III)。该策略最早于2008年被余金权教授课题组在钯(II)催化的不对称碳氢键活化中实现,在该体系中,单保护氨基酸(MPAA)作为双齿手性配体,高效的实现了芳基碳氢键的不对称烷基化。随后,手性羧酸被成功应用于钴、铑、铱催化的不对称碳氢键活化中。然而,由于配位数的限制,(p-Cymene)Ru(II)仅有一个空配位点能够提供给手性羧酸配体,而单齿手性配体的自由旋转,使得立体选择性控制极为困难。因此,迄今为止,尚未有外源手性配体催化的钌(II)催化不对称碳氢键活化的报道。
浙江大学化学系史炳锋课题组(http://mypage.zju.edu.cn/bfshi)长期致力于发展廉价易得的手性配体实现高效的不对称碳氢键活化。近日,他们设计合成了一种结构简单的具有酰胺基团的手性联萘羧酸配体,实现了钌催化的不对称碳氢键活化环化合成手性亚砜亚胺骨架(图1c)。该配体可以从手性联萘-2,2’-二甲酸出发,高效的合成。通过反应条件的优化,该体系对于去对称化,动力学拆分,平行动力学拆分都能以高产率和高对映选择性合成目标产物。初步的实验表明,该反应的立体选择性控制可能源于亚砜亚胺底物中亚胺氢与配体酰胺羰基的氢键作用(N−H···O)。
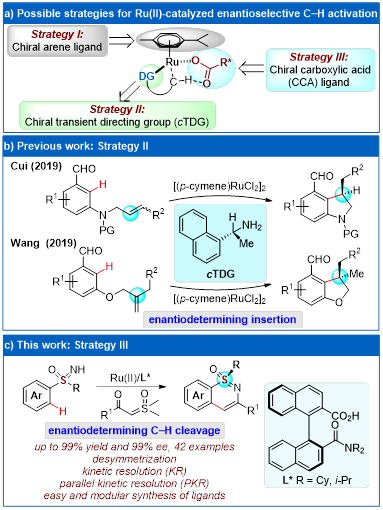
图1 Ru(II) 催化的不对称碳氢键活化
研究人员首先考察了一系列不同的α-羰基硫氧叶立德和亚砜亚胺底物在去对称化反应体系中的耐受性(图2)。硫氧叶立德羰基α-位上连有给电子基团、吸电子基团的苯基,噻吩,呋喃,烷基等都能以较高到优秀的产率(80%-99%)和对映选择性(97%-98%)生成目标产物。同样,卤素,三氟甲基,乙酰基等不同官能团取代的前手性二芳基亚砜亚胺对于该反应体系同样有很好的兼容性。
随后,研究人员考察了动力学拆分策略对于外消旋的亚砜亚胺底物适用范围(图3)。将配体酰胺上的异丙基换成环己基,同时对反应条件进一步优化以后。不同的亚砜亚胺底物都能在与苯甲酰基硫氧叶立德环化反应中实现动力学拆分,反应都能以较高的对映选择性得到环化产物和回收的原料。该反应体系同样适用于平行动力学拆分(图4)。
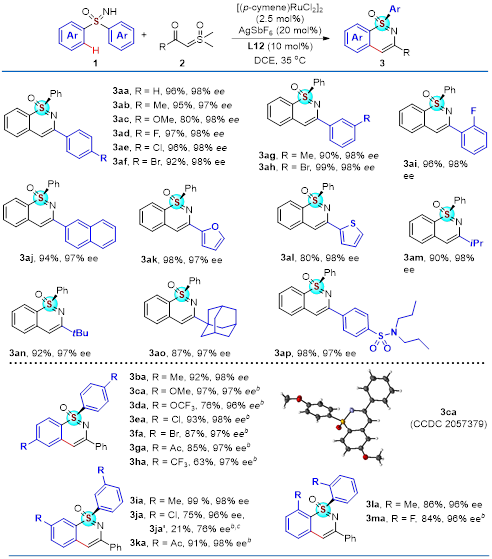
图2 去对称化底物范围
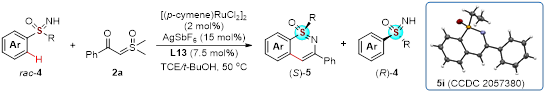
entry | Rac-4 | Ar | R | yield of (S)-5 (%)b | ee of (S)-5 (%)c | yield of (R)-4 (%)b | ee of (R)-4 (%)c | s-valued |
1 | 4a | Ph | Me | 50 | 91 | 41 | 96 | 83 |
2 | 4b | 4-MeC6H4 | Me | 53 | 89 | 38 | 97 | 72 |
3 | 4c | 4-MeOC6H4 | Me | 51 | 83 | 35 | 96 | 42 |
4 | 4d | 4-BrC6H4 | Me | 50 | 78 | 41 | 98 | 36 |
5 | 4e | 4-FC6H4 | Me | 49 | 89 | 40 | 96 | 67 |
6 | 4f | 3-ClC6H4 | Me | 29 (5f), 18 (5f’)e | 64 (5f), 65 (5f’)f | 37 | 97 | 18 |
7 | 4g | 3-AcC6H4 | Me | 46 | 82 | 35 | 86 | 28 |
8 | 4h | 2-ClC6H4 | Me | 52 | 80 | 38 | 99 | 46 |
9 | 4i | Ph | Et | 53 | 86 | 39 | 93 | 45 |
10 | 4j | Ph | Cyclopropyl | 50 | 83 | 41 | 95 | 40 |
11 | 4k | Ph | Bn | 49 | 67 | 35 | 98 | 22 |
图3 动力学拆分底物范围
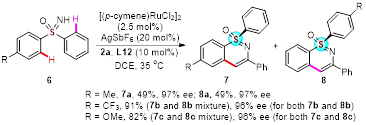
图4 平行动力学拆分底物范围
为了进一步展示该反应潜在应用价值,研究者对该反应进行了衍生化研究(图5)。动力学拆分所得的手性磺酰亚胺经过简单的还原可以得到在不对称催化反应中应用广泛的手性亚砜配体。同时,手性亚砜亚胺是诸多具有良好生物活性药物的关键骨架,研究者将拆分所得的手性磺酰亚胺经过简单的转化,及可以得到人细胞色素P450C24(CYP24)羟化酶11的抑制剂的前体。因此这一催化体系在药物化学中也有较为广阔的应用前景。
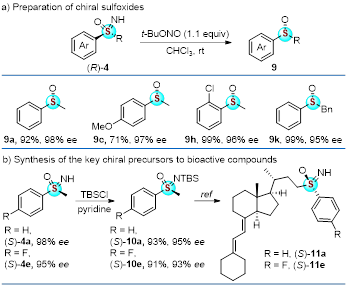
图5 平行动力学拆分底物范围
总 结
浙江大学化学系史炳锋团队通过设计合成了一类新的手性羧酸配体,实现了首例Ru(II)催化的通过碳氢键活化产生手性中心的不对称官能团化反应。该反应体系对于去对称化,动力学拆分,平行动力学拆分都能有很好的底物兼容性。同时反应生成的高光学纯的手性亚砜亚胺有较为广阔的应用前景。
这一成果近期发表在《美国化学会志》(Journal of the American Chemical Society)上,文章的通讯作者是史炳锋教授,博士后周涛为该文第一作者,浙江大学2018级本科生钱璞凡,李俊逸,周弋渤,李浩辰和2019级本科生陈浩宇共同参与完成。该成果获得国家自然科学基金、国家级大学生创新创业训练计划、浙江省大学生科技创新活动计划(新苗人才计划)和浙江大学本科生科研实践项目的支持。
Efficient Synthesis of Sulfur-Stereogenic Sulfoximines via Ru(II)-Catalyzed Enantioselective C−H Functionalization Enabled by Chiral Carboxylic Acid
Tao Zhou, Pu-Fan Qian, Jun-Yi Li, Yi-Bo Zhou, Hao-Chen Li, Hao-Yu Chen, and Bing-Feng Shi*
J. Am. Chem. Soc. 2021, 143, 6810-6816.

