汤谷平教授团队:主客体器件在炎性相关结肠癌治疗和肿瘤微环境调控领域取得研究进展
以药物和载体材料构建药物输送系统,并利用材料自身理化特性实现药物活性成分的包载、靶向递送和控制释放,是纳米医学领域的研究热点。作为大环类化合物之一,环糊精不仅具有独特的分子器件特性,在催化、分离、食品以及制药领域应用广泛,也是构建智能纳米药物的分子载体,进一步地环糊精具有特殊的生物学效应,其通过介导巨噬细胞代谢调控炎性反应。因此,将环糊精理化特性和生物学特性有机结合,参与生/病理调控并辅助药物治疗,对于深入研究载体材料生物学效应、设计药物-载体协同增效型纳米药物具有重要意义。
北京时间2月3日,这项研究发表在国际知名期刊《自然通讯》(Nature Communication)上,化学系白宏震博士后为论文的第一作者,化学系汤谷平教授和浙江大学医学院免疫所来利华副教授为共同通讯作者。研究团队针对结肠癌发病机制、生/病理微环境特征,以甘露糖功能化环糊精(CD)为主体分子,分子靶向药物瑞戈非尼(RG)为客体分子,设计了一种全新的主-客体自组装纳米药物器件。用环糊精多级组装特性构建具有孔道堆积微结构的、口服型纳米药物(RG@M-CD)。RG@M-CD独特的纳米孔道结构能够降低胃酸对药物活性成分的破坏,在肠环境中进行逐级解组装,发挥药物缓释作用,极大提高瑞戈非尼的肠部位富集。此外,RG@M-CD针对结肠癌肿瘤细胞及肿瘤相关巨噬细胞高表达甘露糖受体的特点,借助甘露糖功能化修饰实现对肿瘤组织的主动靶向,显著提高癌变部位的药物浸润。通过建立结肠癌实体瘤和炎性相关结肠癌模型,研究了RG@M-CD纳米药物的抗肿瘤能力。通过基因芯片技术、生物信息学分析等方法,深入研究了RG@M-CD纳米药物抑制结肠癌细胞恶性进程、阻断肿瘤部位血管新生和调控肿瘤微环境的内在机理。阐述了RG@M-CD纳米药物的作用机理和临床应用潜力,为结肠癌的治疗和纳米药物设计提供了全新视角。
本项研究工作得到农生环测试中心的王华老师,化学系分析测试平台的何巧红、陈林深、陈芳、刘亚琴老师在材料表征上的帮助,医学院潘婷老师、熊佳博士在分子生物学实验中的帮助,同时感谢浙江中医药大学病理学系金晓琴老师在病理切片实验上的帮助。
研究成果在线发表在国际综合类期刊Nature Communications(DOI: 10.1038/s41467-021-21071-0)上。研究项目得到了国家自然科学基金(No. 51573161, No.51873185和No.81771699)的资助。

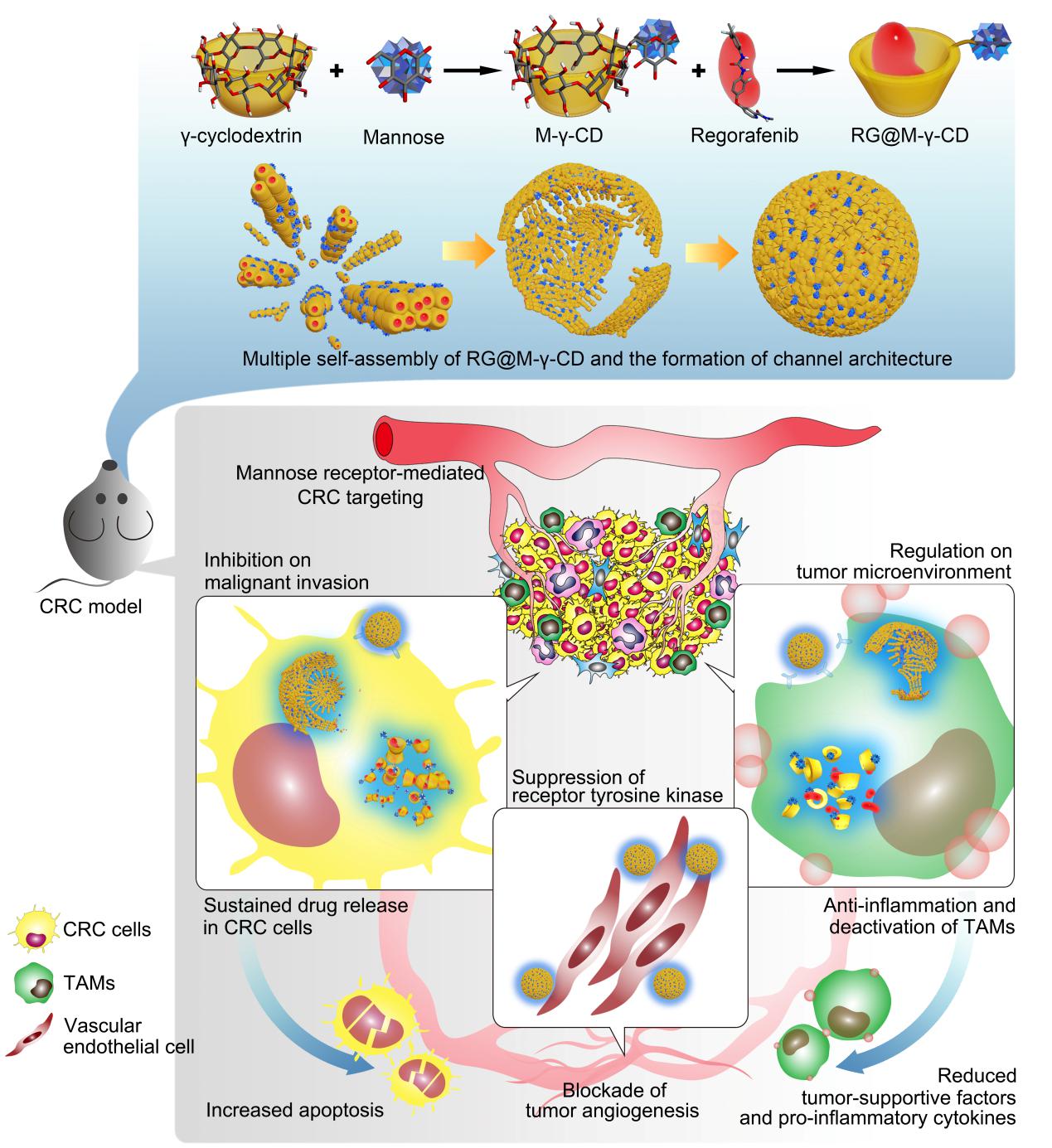
图1环糊精主客体纳米药物及其作用机制示意图
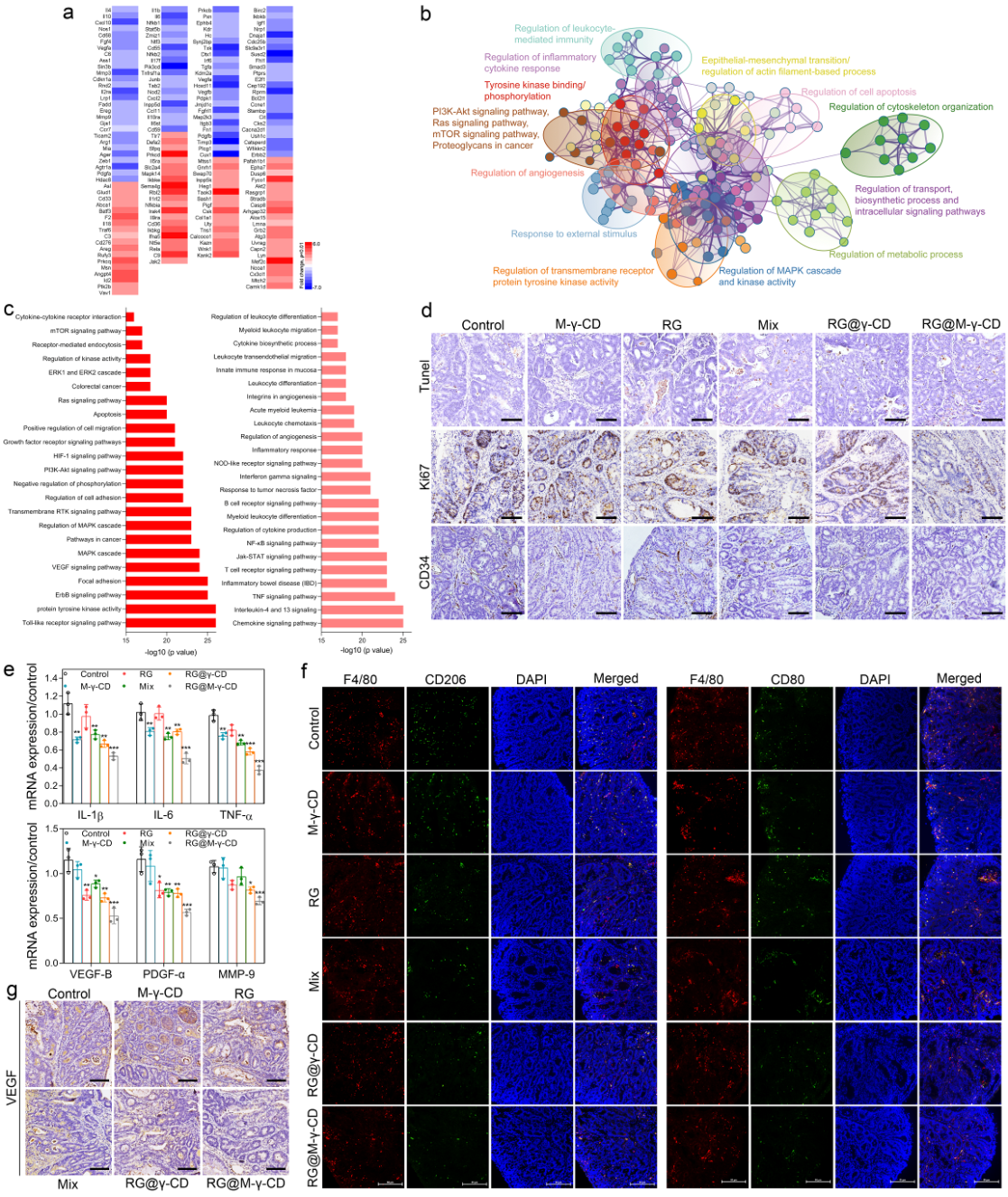
图2环糊精主客体纳米药物对炎性相关结肠癌及肿瘤微环境的协同调控

