汤谷平教授课题组在Advanced Materials发表最新研究:抗肿瘤疫苗作用的新型原核-真核细胞膜杂交型纳米药物输送体系
将不同来源的生物膜蛋白进行融合修饰,作为免疫治疗药物的输送体系是一种全新的纳米输送策略。仿生膜药物递送系统能够模拟生物膜的结构和功能,与传统药物递送系统相比,具有突破生理屏障、精准地将药物输送至靶部位、减少药物副反应和提高药物疗效的作用。近日,浙江大学化学系汤谷平教授课题组陈琪博士研究生和白宏震博士后提出一种新的纳米技术,将原核细胞膜与真核细胞膜融合,制备杂交囊泡(EPV)纳米颗粒方法,用以提高生物纳米载体的功能性,拓展其应用价值。该研究论文设计了以减毒的沙门氏菌细菌外膜囊泡和黑色素癌细胞膜囊泡融合形成新型的原核-真核细胞膜杂交膜(EPV)纳米技术,作为肿瘤的预防疫苗及用于癌症的免疫治疗。设计采用的EPV继承了细胞膜母体组成的优点,将黑色素瘤抗原与天然佐剂整合在一起,可进行稳定的免疫治疗,并且可以通过联合疗法如光热、光动力治疗,化疗等,进行复合型功能化治疗。体内预防实验表明,EPV纳米技术可以用作肿瘤的预防疫苗,可以刺激免疫系统并触发抗肿瘤免疫反应,对肿瘤的发生起到很好的抑制作用。在黑色素瘤治疗模型中,聚乳酸-乙醇酸(PLGA)-吲哚菁绿(ICG)纳米粒子(PI)与EPV整合形成PI @ EPV的复合型功能化纳米药物输送体系,可以实现局部光热疗法联合持久免疫抑制作用。肿瘤治疗研究结果显示,该体系具有协同增效的抗肿瘤作用。将真核细菌膜-原核细胞膜融合作为药物输送体系,是一种全新的研究思路和策略,其为肿瘤免疫原、自佐剂和肿瘤疫苗的研究提供了全新的设计思路和应用视角。
该研究成果由2015级博士研究生陈琪为第一作者,白宏震博士和汤谷平教授为通讯作者。研究成果在线发表在材料化学期刊Advanced Materials (DOI: 10.1002/adma.201908185,IF=25.08)上。研究项目得到了国家自然科学基金(No.51573161 和No.51873185)的资助。
论文链接:https://doi.org/10.1002/adma.201908185

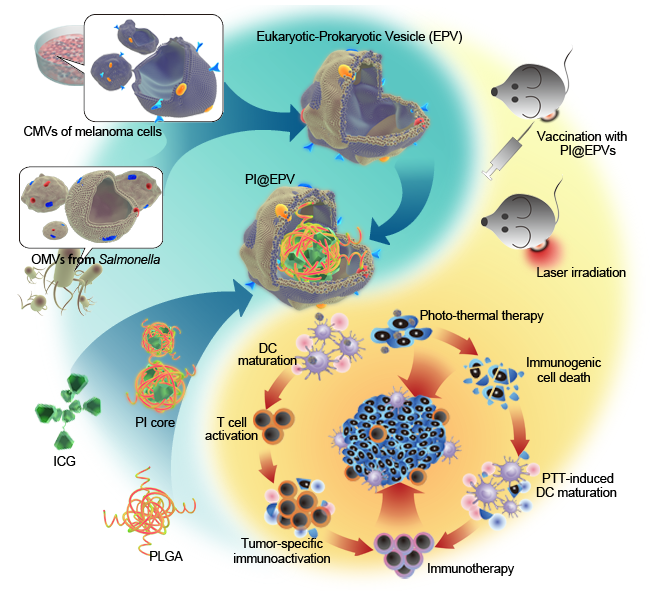
新型原核-真核细胞膜杂交型纳米药物体系功能示意图
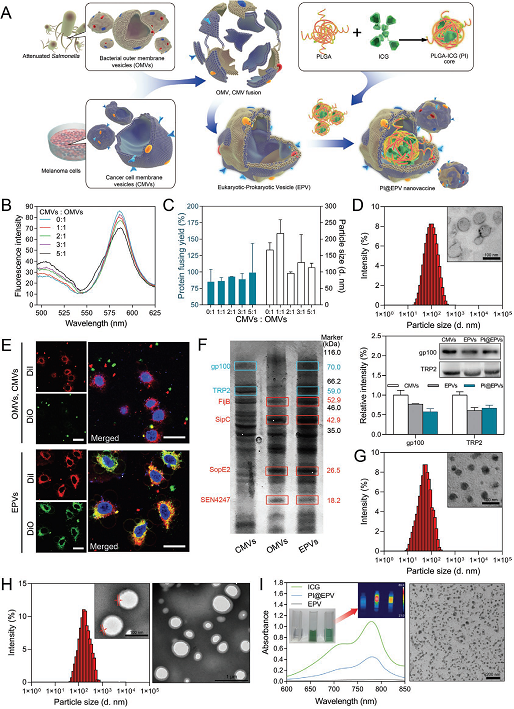
图 1 新型原核-真核细胞膜杂交型纳米药物体系的制备及表征

图 2新型原核-真核细胞膜杂交型纳米药物体系的体外细胞学性质

图 3 原核-真核细胞膜杂交型纳米药物体系的预防研究
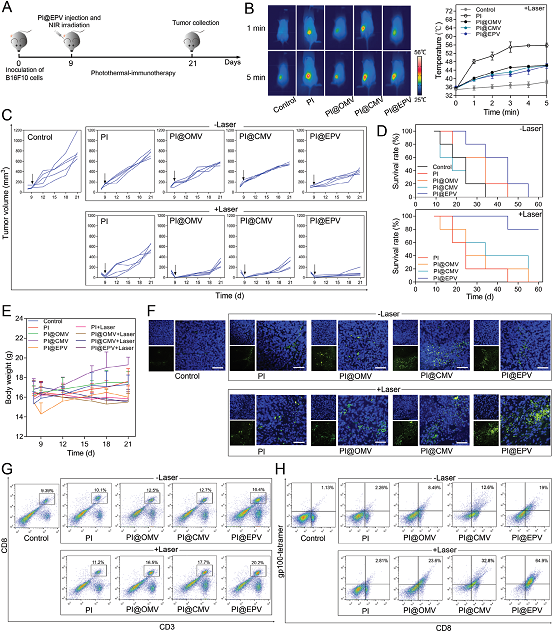
图 4 原核-真核细胞膜杂交型纳米药物体系的治疗研究

